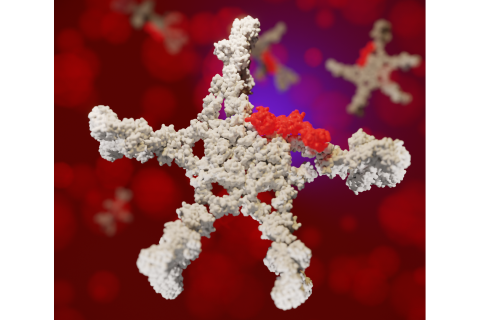
Een van de meest voorkomende antilichamen in ons bloed, Immunoglobuline M (IgM), blijkt anders in elkaar te zitten dan gedacht: het bevat een extra eiwit, genaamd CD5L. Utrechtse onderzoekers onder leiding van Albert Heck en collega’s van het Amsterdamse Sanquin deden deze ontdekking, die nu is gepubliceerd in het wetenschappelijke tijdschrift PNAS. Niet alleen betekent het nieuwe inzicht dat tekstboeken over biochemie en immunologie moeten worden aangepast, ook heeft de ontdekking gevolgen voor therapeutische toepassingen.
IgM wordt al decennia bestudeerd in laboratoria over de hele wereld. Al in de jaren negentig dacht men nauwkeurig bepaald te hebben hoe het antilichaam in elkaar zit: het is een erg groot molecuul dat de vorm heeft van een pentameer, een ‘zeester’ met vijf armen. Deze structuur staat zo beschreven in alle tekstboeken. En hoewel het al bekend was dat CD5L kan binden aan deze ‘zeester’, tonen de Utrechtse en Amsterdamse onderzoekers nu voor het eerst aan dat CD5L gebonden is aan ál het IgM dat zich in het bloed bevindt.
De ontdekking kwam voor de onderzoekers als een grote verrassing. Heck: “Als je zoiets als eerste ontdekt, dan denk je: hoe kan dat nou? IgM is al door duizenden mensen bestudeerd. Waarom zijn wij de eersten die dit zien? (…) Het laat goed zien dat als je blind uitgaat van wat er in de tekstboeken staat, je dingen over het hoofd kunt zien.”
Lees het hele bericht op de site van de Universiteit Utrecht.